Todos conocemos y utilizamos a diario las pilas, esos elementos que almacenan energía y que se utilizan en múltiples aparatos domésticos. Pero ¿sabemos cómo son en su interior y cómo funcionan? En este post vamos a tratar de explicarlo y de ver qué tipos de pilas diferentes podemos encontrar en el mercado.
¿Qué es una pila?
Una pila o batería es un dispositivo que convierte la energía química de su interior en energía eléctrica en el exterior.
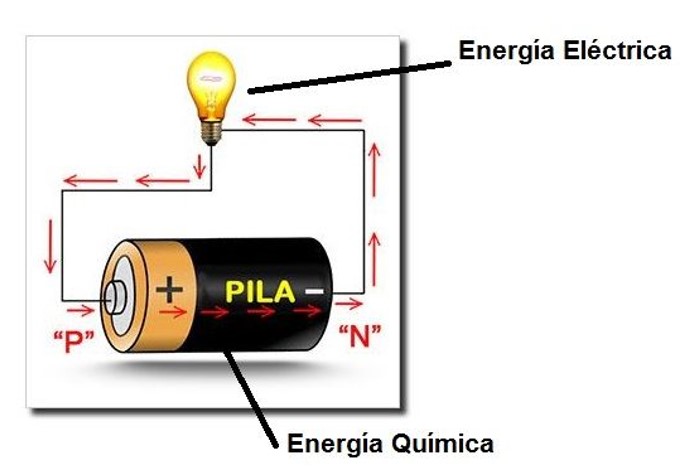
A pesar de que en muchas ocasiones utilizamos los términos <<pila>> y <<batería>> de forma indistinta, son dos conceptos diferentes. Como ya comentamos en el artículo “Dosier básico sobre baterías” la pila es un dispositivo no recargable, en cambio la batería sí se puede recargar.
Otra diferencia entre ambas es que las pilas mantienen su carga durante años, mientras que las baterías tienen una pequeña autodescarga que hace que puedan perder su carga en unos meses si no se les realiza un mantenimiento.
Es importante saber con qué tipo de elemento estamos trabajando ya que si intentamos recargar una pila puede resultar muy peligroso.
Partes de una pila alcalina
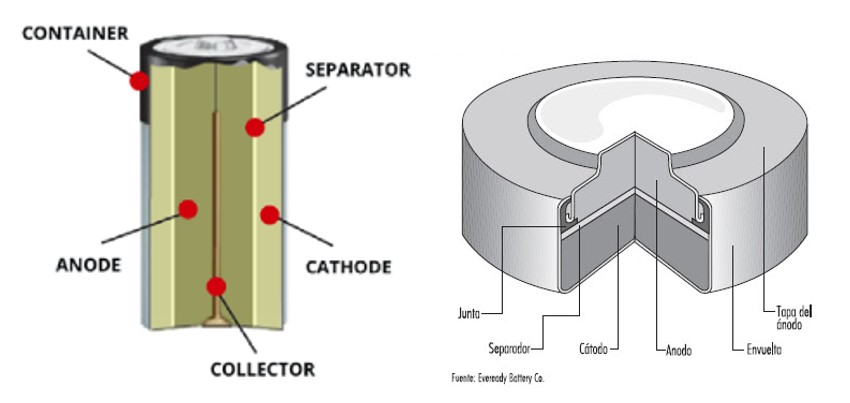
Aunque existen distintos tipos de pilas todas ellas tienen la misma estructura básica. Dependiendo de la tecnología de la pila pueden diferir en los compuestos que contienen y en función del formato puede variar la distribución, pero la estructura será similar. Vamos a ver el ejemplo de una pila alcalina. Desde la parte exterior hacia el interior de la pila:
- Carcasa o contenedor: revestimiento de acero que almacena los componentes de la pila y conforma el cátodo.
- Cátodo: mezcla de dióxido de manganeso y carbono. En la reacción química es el elemento en el que se produce la reducción.
- Separador: tejido fibroso que separa el cátodo y el ánodo.
- Ánodo: compuesto por polvo de zinc. En la reacción química es el elemento que se oxida.
- Electrolito: solución de hidróxido de potasio en agua que actúa como medio para el movimiento de los iones dentro de la pila.
- Colector: una especie de alfiler de bronce en medio de la pila que conduce la electricidad al circuito exterior.
Funcionamiento de una pila
Debemos recordar que una pila (o una batería) es un elemento químico y su funcionamiento reside en una celda galvánica en la que se produce una reacción reducción-oxidación (redox) de ciertas sustancias químicas, estas sustancias son diferentes según el tipo de pila o batería.
En una reacción de este tipo contribuyen las siguientes partes:
- Ánodo: polo negativo. Electrodo que libera electrones durante la descarga (reacción de oxidación). En la imagen de la celda galvánica está formado por sulfato de zinc.
- Cátodo: polo positivo. Electrodo que absorbe electrones durante la descarga (reacción de reducción). En la imagen de la celda galvánica está formado por sulfato de cobre.
- Electrolito: conductor que transfiere la carga entre ánodo y el cátodo dentro de la celda. En la imagen son los dos sulfatos del metal correspondiente.
- Separador: puede ser un puente salino o una placa porosa. En una pila será una placa porosa y hace de barrera entre el ánodo y el cátodo para evitar que se toquen entre sí. Se encuentra humedecido con el electrolito que es el que permite el movimiento de los electrones. En la imagen tenemos un puente salino.
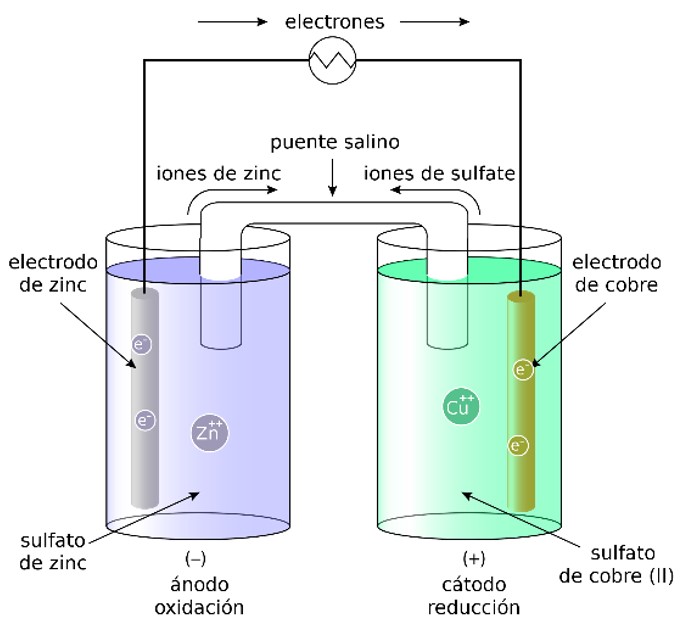
La reacción química no se produce hasta que se cierra el circuito conectando la pila a una carga externa (lámpara, motor, etc.), de manera que los electrones empiezan a circular del polo negativo al positivo. Así comienza la descarga de la pila.
Durante el proceso de descarga el ánodo libera electrones (oxidación) que fluyen hacia el circuito externo debido a la diferencia de potencial existente entre los electrodos, esto es la corriente eléctrica. Después los electrones vuelven a la pila por el cátodo (reducción).
Las soluciones en los electrolitos buscarán el equilibrio en la carga eléctrica, por lo que los iones de sulfato viajarán a través del puente salino, en dirección opuesta a los electrones para compensar el desequilibrio.
La reacción que se produce no es interminable, la interacción entre el zinc y el electrolito genera sustancias que van disminuyendo el voltaje de la pila. Además, las sustancias se van volviendo cada vez menos activas. Estos factores combinados hacen que la carga de la pila se agote de forma gradual.
Tipos de pilas
Las pilas constan de diversas características que nos llevarían a crear multitud de divisiones de estas según su forma, dimensiones, composición, etc. En este caso vamos a desarrollar una división genérica de las pilas más habituales según su forma y a su vez según su composición.
Existe un estándar de nomenclatura de pilas que permite que sean intercambiables entre los modelos de distintos fabricantes. Estas nomenclaturas están establecidas por las organizaciones de estándares IEC (Comisión Electrotécnica Internacional) y el ANSI (Instituto de Estándares Nacional Americano), cada uno de ellos utiliza sus códigos. Además, algunas marcas utilizan sus propios códigos, por lo que podemos encontrar multitud de referencias para modelos de pila equivalentes. Nosotros en este artículo nos centraremos en el código IEC.
En la siguiente tabla se muestra un resumen de los tipos de pilas atendiendo a su forma y composición:

* Se indica el voltaje por celda, ya que en algunos casos una pila se compone de varias celdas en serie lo que hace que su voltaje sea mayor. En este caso su código IEC empieza por un número que indica el número de celdas en serie que lleva. Su voltaje será el resultado de multiplicar el voltaje por celda por el número de celdas. Lo veremos en algunos ejemplos más tarde.
Cilíndricas
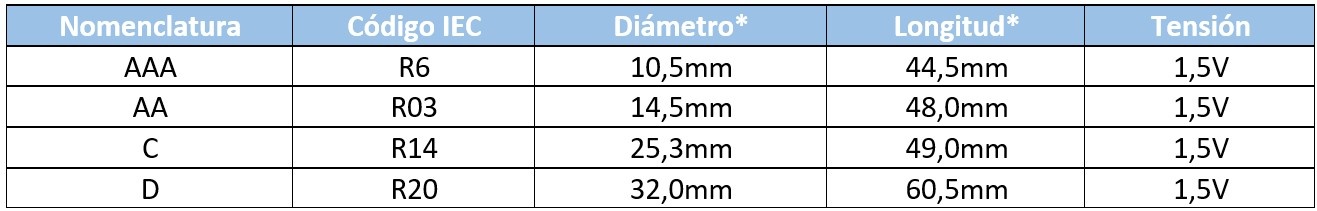
Aunque comúnmente conocemos estos modelos por la nomenclatura AA, AAA, D, etc. este dato únicamente nos da el valor del diámetro de la pila, por ello lo más correcto sería referirse a una pila por su código IEC o ANSI.


*Estos valores pueden variar ligeramente según la marca.
Alcalinas
Son las pilas más comunes, las que utilizamos en el día a día en multitud de aplicaciones y seguramente las que a todos se nos vienen a la cabeza cuando hablamos de una pila.
Se componen de zinc en el ánodo y de dióxido de manganeso en el cátodo (MnO2).
Algunos de los modelos más comunes son los siguientes:

*Estos valores pueden variar ligeramente según la marca.
Aplicaciones: juguetes, mandos a distancia, linternas, relojes de pared, teclados, ratones, etc.
Salinas
Se componen de zinc-carbono. Son las más antiguas.
Acumulan menos energía que las pilas alcalinas y suelen utilizarse en aparatos de bajo consumo. Son más baratas que las alcalinas, pero son menos utilizadas.
*Estos valores pueden variar ligeramente según la marca.
Aplicaciones: mandos a distancia, radio, aparatos de medida, despertador, etc.
De litio
Tienen una alta densidad de energía y una autodescarga muy baja. Se pueden utilizar en dispositivos de alto consumo.
Como veíamos en la primera tabla que resume las diferentes tecnologías, hay diferentes tipos de pilas de litio según los elementos de su composición y cada una de las combinaciones aporta un voltaje diferente, por lo que es importante saber qué modelo es el apropiado.
En un post anterior ya hablamos de las diferencias entre las tres tecnologías en pilas de litio, puedes consultarlo aquí.

En la siguiente tabla vemos una comparación de pilas AA en las tres tecnologías de litio. Aunque por las dimensiones podríamos pensar que una pila alcalina podría sustituirse por cualquiera de ellas esto no es así. Debemos tener mucho cuidado ya que el voltaje que ofrece cada tecnología es diferente y no todas son intercambiables.

*Estos valores pueden variar ligeramente según la marca.
Aplicaciones: cámaras, linternas, alarmas, etc.
Prismáticas

De características similares a las cilíndricas, pero con forma de prisma rectangular. Son menos comunes que las cilíndricas, aunque también se usan en muchas aplicaciones. En este caso suelen estar formadas por varias celdas por lo que su voltaje es mayor y múltiplo de 1.5V.
Aplicaciones: micrófonos, detectores de humo, equipos de medición, etc.
Alcalinas
Su código IEC también consta de las letras “LR” pero en este caso suele ir precedido de un número que indica la cantidad de celdas de 1.5V que lleva en serie y que nos da una idea del voltaje que tiene la pila.
Por ejemplo, en el modelo 6LR61, el número 6 que precede a las letras “LR” indica que consta de 6 celdas en serie de 1.5V, por lo que el valor del voltaje de esta pila será 6 x 1.5V = 9V.
Salinas
Estos modelos están prácticamente en desuso, aunque comúnmente aún se utilizan los códigos de los modelos de pilas salinas para referirnos a su equivalente alcalina o de litio. Por ejemplo, el modelo 6F22 en muchas ocasiones se utiliza para referirnos a la pila del mismo formato en su versión alcalina 6LR61.
Su código IEC lleva la letra “F”.
Son adecuadas para equipos de bajo consumo.
De litio
Podemos encontrar modelos tanto de Litio/Cloruro de tionilo como de Litio/Dióxido de Manganeso.
Igual que para los modelos cilíndricos su código IEC se formará con las letras “ER” para el Li/SOCl2 y con “CR” para el Li/MnO2.
En los modelos de Cloruro de tionilo, por ejemplo, para el modelo ER9V podemos encontrar marcas que etiquetan las pilas con un voltaje de 9V y otras como 10.8V. Si nos fijamos en el valor del voltaje que tiene la celda unidad son 3.6V, por lo que 9V no es múltiplo de este valor. En realidad, en todas el voltaje nominal será de 10.8V (3 celdas de 3.6V) pero la inercia en este formato nos lleva a marcarlas como 9V “para entendernos”.
Comparamos un formato similar en cada una de las tecnologías:
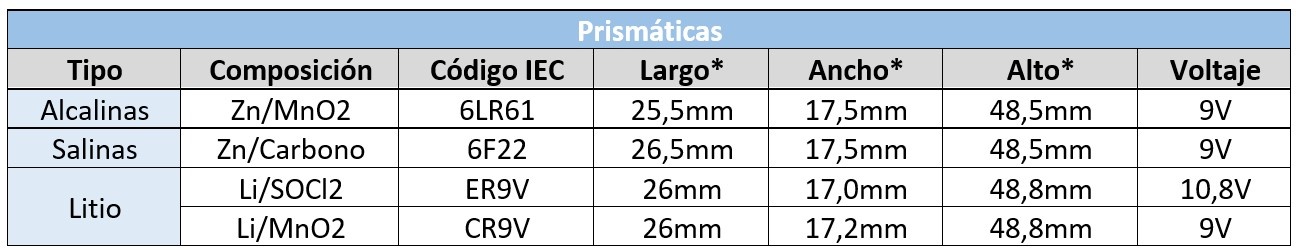
*Estos valores pueden variar ligeramente según la marca.
Botón
Son pilas de tamaño muy reducido que se utilizan para pequeños aparatos electrónicos. Se presentan en diferentes tecnologías y multitud de tamaños distintos.

Aplicaciones: calculadoras, relojes de muñeca, audífonos, llaves de coche, juguetes, cámaras, etc.
Alcalinas
Como todas las alcalinas su código IEC también consta de las letras “LR”. Su tensión eléctrica es de 1,5V.
De óxido de plata
Su código IEC se compone de las letras “SR”. Su tensión eléctrica es de 1,55V.
Presentan una curva de descarga más plana que las alcalinas.
De zinc-aire
Su prefijo en el código IEC es “PR” y su tensión es de 1,4V.
Tienen alta densidad de energía y son relativamente baratas.

*Estos valores pueden variar ligeramente según la marca.
De litio
Su código IEC lleva el prefijo “CR” para el compuesto Litio Dióxido de Manganeso (3V), “BR” para el compuesto Litio Monofluoruro de Policarbonato (3V) y “TL” para el Litio Cloruro de Tionilo (3,6V).
El código IEC se completa con un valor numérico que consta de las cifras que definen el diámetro y la altura de la pila. Por ejemplo, el modelo CR2450 tendrá 24mm de diámetro y 5mm de alto (aproximadamente).
Presentan larga vida útil.

*Estos valores pueden variar ligeramente según la marca.
Como se puede observar existe una amplia variedad de pilas en el mercado y no todas son ideales para cualquier aplicación. Desde Fullwat tratamos siempre asesorar a nuestros clientes para procurar sacar el máximo partido a las pilas y baterías en cada aplicación.

